Niels Henrik David Bohr
Em 1913, Niels
Böhr, por
meio de pesquisas e análise das teorias da época, como a do efeito Zeeman,
do efeito fotoelétrico, das séries espectrais dos elementos químicos e,
principalmente, a teoria de Planck, Böhr percebeu que deveria haver alguma
relação entre as energias dos elétrons em suas órbitas atômicas e as
correspondentes freqüências, conforme sugeria a teoria da radiação de Max
Planck.
Por que a luz comum forma o
arco-íris ao passar por uma nuvem? Por que certos átomos quando aquecidos,
emitem luz de uma só cor, como acontece com as “lâmpadas de sódio” (luz
amarela) existentes em nossas estradas?
Böhr propôs a
seguinte explicação para estes fenômenos:
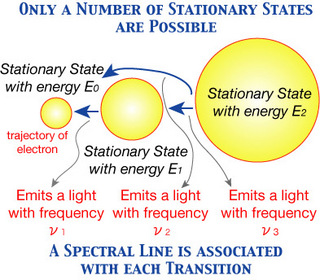
“Os elétrons
giram ao redor do núcleo em um número limitado de órbitas bem definidas, que
são denominadas de órbitas estacionárias, com determinados níveis de
energia.
Quando um elétron
absorve uma determinada quantidade de energia do exterior (luz, calor ou
eletricidade) ele salta para uma órbita (nível) mais energética (estado
excitado).
Salto
do elétron
Ao retornar para
a órbita original, o elétron perde energia na forma de ondas
eletromagnéticas (luz de cor bem definida).
Retorno
do elétron
Esses saltos se
repetem milhões de vezes por segundo, produzindo assim uma onda
eletromagnética, que nada mais é do que uma sucessão de ondas emitidas.
POSTULADOS DE BÖHR
- A energia radiada não é emitida ou absorvida de maneira contínua, somente quando um elétron passa de uma órbita estacionária para outra diferente ( salto quântico ).
- Os elétrons giram em torno do núcleo em órbitas circulares e bem definidas (fixas) que são as órbitas estacionárias. Mais tarde, seriam as chamadas "camadas eletrônicas" (K,L,M,N,O,P e Q).
- O equilíbrio dinâmico dos sistemas nos estados estacionários se dá pelas leis da mecânica clássica, o que não é verificado quando um elétron passa para um diferente estado estacionário.
- Ao passar de um estado estacionário para outro, um elétron absorve uma radiação bem definida, que é o quantum, dado pela relação E = h.v , onde v é a freqüência e h é a constante de Planck.
Simplificando, observamos que:
| quando um elétron RECEBE energia, ele salta para uma órbita MAIS EXTERNA. A quantidade de energia absorvida é bem definida ( quantum ) e equivale à diferença energética entre as camadas. | |
| quando um elétron volta para o seu estado estacionário (órbita mais interna), ele LIBERA ou IRRADIA energia sob a forma de raio X, ultravioleta ou luz, que seria o fóton. Essa energia também é muito bem definida ( quantum ). | |
| Cuidado com os conceitos de ELÉTRON ESTACIONÁRIO ( girando em sua órbita normal, em seu estado estacionário ) e ELÉTRON ATIVADO ou EXCITADO ( aquele que saltou para um nível mais externo pela absorção de energia ). |
APLICAÇÕES DO MODELO DE BOHR
-Teste da chama
Teste da chama com CuSO4: uma das mais
importantes propriedades dos elétrons é que suas energias são
"quantizadas",ou seja, um elétron ocupa sempre um nível energético bem
definido e não um valor qualquer de energia. Se no entanto um elétron for
submetido a um fonte de enrgia adequada (calor, luz, etc.), pode sofrer uma
mudança de um nível mais baixo para outro de energia mais alto (excitação).
O estado excitado é um estado meta-estável (de curtíssima duração) e,
portanto, o elétron retorna imediatamente ao seu estado fundamental. A
energia ganha durante a excitação é então emitida na forma de radiação
visível do espectro eletromagnético que o olho humano é capaz de detectar ou
não. Como o elemento emite uma radiação característica, ela pode ser usada
como método analítico
-Fogos de artificio
FOGOS DE ARTIFÍCIO: Os fogos de artifício modernos empregam perclorato,
substâncias orgânicas como amido ou açúcar, produtos do petróleo e pequenas
quantidades de metais para dar cor. O funcionamento fundamenta-se na
excitação dos elétrons que, ao retornarem a sua órbita original, emitem luz
com cores diferentes. Aqui, uma exibição de fogos de artifício na cidade de
Nova York.
-Luminosos e lâmpadas (neônio e lâmpadas de vapor de Na ou Hg)
LUMINOSOS: A imagem mostra como brilham as luzes de néon na noite de Las
Vegas (EUA). As lâmpadas de néon são usadas na arte, na publicidade e até em
balizas de aviação. Para fabricá-las, enche-se com gás néon, a baixa
pressão, tubos de vidro dos quais todo o ar foi retirado. Ao aplicar
eletricidade, uma corrente flui através do gás entre os dois eletrodos
fechados dentro do tubo. O néon forma uma banda luminosa entre os dois
eletrodos. (Neônio – luz vermelha, Argônio – luz azul, Neônio + gás
carbônico – luz violeta).
-Fluorescência e Fosforescência:
Luminescência
é a emissão de luz causada por certos materiais que absorvem energia e podem
emiti-la em forma de luz visível. Se o intervalo entre absorção e emissão é
curto (ocorre imediatamente), o processo se denomina fluorescência;
quando o intervalo é longo (ocorre em alguns segundos ou algumas horas),
fosforescência. As telas das televisões são recobertas por materiais
fluorescentes, que brilham ao serem estimulados por um raio catódico. A
fotoluminescência se produz quando determinados materiais são irradiados com
luz visível ou ultravioleta.
Fluorescência se define como as propriedades das
substâncias de adquirirem luminescência ao serem submetidas aos raios
ultravioletas, ou seja, quando são iluminadas.

O melhor exemplo prático da aplicação da fluorescência é a sinalização de trânsito, você já reparou que nas rodovias existem placas que se iluminam quando os faróis do carro vão de encontro a elas. Este efeito permite visualizarmos o que está escrito nas placas, imagine se não existisse esta propriedade? Como as placas seriam lidas à noite? Mas quais substâncias são responsáveis por este fenômeno químico? O Tetracianoplatinato de Bário e Sulfeto de Zinco (ZnS). A excitação dos elétrons produz energia capaz de gerar luz.
Os interruptores feitos com material fosforescente são visíveis no escuro
graças ao retorno gradual dos elétrons excitados.

Fosforescência é observada quando uma substância possui luminescência própria, por exemplo, os mostradores de relógio
-Raio Laser

O raio laser é um tipo de radiação eletromagnética visível
ao olho humano. O laser hoje é muito aplicado como, por exemplo, nas
cirurgias médicas, em pesquisas científicas, na holografia, nos leitores de
CD e DVD como também no laser pointer utilizado para apresentação de slides.
Na indústria o laser de dióxido de carbono tem sido muito utilizado, pois
possibilita um processo rápido de corte e solda de materiais
-Bioluminescência: a luz dos vaga-lumes.
O vaga-lume é um inseto coleóptero que possui emissões
luminosas devido aos órgãos fosforescentes localizados na parte inferior do
abdômen. Essas emissões luminosas são chamadas de bioluminescência e
acontecem devido a reações químicas onde a luciferina é oxidada pelo
oxigênio nuclear produzindo oxiluciferina que perde energia fazendo com que
o inseto emita luz. Na reação química, cerca de 95% aproximadamente da
energia produzida transforma-se em luz e somente 5% aproximadamente se
transforma em calor. O tecido que emite a luz é ligado na traquéia e no
cérebro dando ao inseto total controle sobre sua luz.
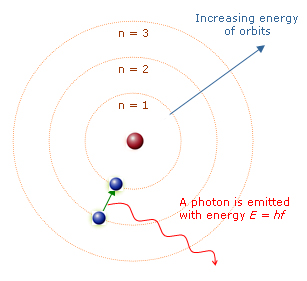
ELETROSFERA
As
idéias estabelecidas por Böhr contribuíram para estabelecer que no moderno
modelo atômico, os elétrons devem se distribuir na eletrosfera do átomo em
determinados níveis de energia (n), sendo conhecidos atualmente 7 níveis de
energia (n = 1, 2, 3, 4, 5, 6, 7) ou, ainda, 7 camadas eletrônicas (K, L,
M, N, O, P, Q).
Em
cada camada ou nível de energia existe um número máximo de elétrons
determinado experimentalmente.
A
seguir temos os níveis (camadas) e o número máximo de elétrons permitidos
para os atuais elementos:
|
Camada
|
Nível de energia (n)
|
Número máximo de elétrons
|
|
K
|
1
|
2
|
|
L
|
2
|
8
|
|
M
|
3
|
18
|
|
N
|
4
|
32
|
|
O
|
5
|
32
|
|
P
|
6
|
18
|
|
Q
|
7
|
8
|
- Teste da chama
É um procedimento utilizado em Química para detectar a presença de
alguns íons metálicos, baseado no espectro de emissão característico de
cada elemento.
O teste de chama é rápido e fácil de ser feito, e
não requer nenhum equipamento que não seja encontrado normalmente num
laboratório de química. Porém, a quantidade de elementos detectáveis é
pequena e existe uma dificuldade em detectar concentrações baixas de
alguns elementos, enquanto que outros elementos produzem cores muito
fortes que tendem a mascarar sinais mais fracos.
A temperatura
da chama do bico de Bunsen é suficiente para excitar uma quantidade de
elétrons de certos elementos que emitem luz ao retornarem ao estado
fundamental de cor e intensidade, que podem ser detectados com
considerável certeza e sensibilidade através da observação visual da
chama.
Um átomo no estado fundamental tem seus elétrons no
menor estado de energia possível. Este estado é aquele como as
substancias normalmente se apresenta na natureza. Entretanto, quando o
átomo sofre alterações de energia, por exemplo, através do aquecimento
resultante da colisão com outros átomos, seus elétrons são promovidos
passando a se mover numa outra orbita, de nível energético mais intenso.
Realizamos a aula no laboratório de Ciências com a turma do 1ºano C da manhã com o teste de chamas. Utilizamos um arame com a solução de cloreto de sódio e sulfato de cobre para observarmos os flash de luz sobre a chama. Depois fizemos o mesmo procedimento utilizando raspas de magnésio.