2º B Manhã
2º A Tarde
sexta-feira, 23 de novembro de 2012
Substitua mil calorias vazias por mil caloriascom alimentos nutritivos
Prestar atenção no valor calórico
dos alimentos ajuda a manter o peso
Bem Estar desta quarta-feira (3) convidou a nutricionista Mônica Beyruti.
Endocrinologista Alfredo Halpern deu dicas para não ultrapassar o limite.

Muitas vezes consumiomos alimentos que são verdadeiras bombas calóricas disfarçadas, enquanto outros não engordam tanto quanto parecem. E é importante ficar de olho nessas quantidades para não ultrapassar o valor diário recomendado: 2 mil calorias para as mulheres e 2.500 para os homens, em média.
Para falar sobre somas, trocas, ajustes e equilíbrios calóricos, o Bem Estar desta quarta-feira (3) contou com a presença do endocrinologista Alfredo Halpern e da nutricionista Mônica Beyruti.
No Jogo da Equivalências das Calorias, o programa mostrou 25 alimentos, e um casal participante teve que acertar o valor calórico de cada um.

No café da manhã, por volta das 9h, Sueli come meio pãozinho ou duas bisnaguinhas e café com leite. Também gosta de presunto e queijo puros, sem pão. No almoço, opta por feijão. Massas, só uma vez por semana. Ela também adora verduras e legumes: alface, rúcula, tomate seco e abobrinha, além de champignon.

Já o marido e empresário Osmar Costa, de 50 anos, leva uma vida sedentária e estressante: passa o dia inteiro sem se alimentar e come muito à noite. Procura dormir 7 horas por noite, mas reconhece que é difícil. No café da manhã, toma apenas um cafezinho preto. No almoço, não costuma comer nada, e começa a trabalhar por volta do meio-dia. À tarde, raramente come algo no escritório, só quando sente fome.
No jantar, ele pega pesado, apesar de Sueli sempre se preocupar em preparar uma salada. De vez em quando, Osmar come sanduíches em lanchonete, mas dificilmente fast food e salgadinhos. Prefere comida na chapa e não bebe nada de álcool há 16 anos: apenas água, refrigerante e café. Também não gosta de leite nem de suco, mas não dispensa um queijinho nem consegue voltar do supermercado sem uma caixa de bombom. Depois das refeições, sempre procura algum doce. E diz que não se preocupa com rótulos nem com calorias.
saiba mais
Valor calórico dos alimentosSalgados
- Misto-quente = 340 calorias
- Meio pão na chapa com manteiga = 230 calorias
- Pão de queijo = 220 calorias
- Empadinha de palmito = 200 calorias
- Pipoca de panela (1 xícara) = 70 calorias
- Salgadinhos (1 xícara) = 100 calorias
- Macarrão instantâneo (1 pacote) = 400 calorias
- Bife grelhado (100 g) = 170 calorias
- Filé de frango grelhado (100 g) = 100 calorias
- Filé de peixe grelhado (100 g) = 100 calorias
- Filé de peixe à milanesa (100 g) = 265 calorias
Doces
- Bolo de chocolate (pedaço médio, sem recheio nem cobertura) = 350 calorias
- Pudim de leite (1 fatia média) = 240 calorias
- Bombom (20 g) = 110 calorias
- Brigadeiro pequeno = 60 calorias
- Leite condensado (1 colher de sopa) = 50 calorias
- Biscoito recheado (unidade) = 40 calorias
- Bolacha água e sal (unidade) = 20 calorias
- Meio mamão papaia = 50 calorias
- Açaí com granola (1 tigela de 200 g com granola) = 250 calorias
Líquidos
- Suco de laranja sem açúcar (200 ml) = 120 calorias
- Café com leite e açúcar (1 xícara) = 120 calorias
- Água de coco (200 ml) = 40 calorias
- Suco de uva (1 caixinha) = 110 calorias
- Leite integral (1 copo de 200 ml) = 115 calorias
- Leite desnatado (1 copo de 200 ml) = 60 calorias
- Cuia de chimarrão (200 ml) = 20 calorias
- Refrigerante (1 copo) = 80 calorias
- Chopp (300 ml) = 120 calorias
- Vinho tinto (1 taça de 120 ml) = 100 calorias achocolatado (200 ml) = 200 calorias
Quantidade diária recomendada
Homem
Café da manhã – 500 calorias
Lanche da manhã – 250 calorias
Almoço – 750 calorias
Lanche da tarde – 250 calorias
Jantar – 750 calorias
Total: 2.500 calorias
Mulher
Café da manhã – 400 calorias
Lanche da manhã – 200 calorias
Almoço – 600 calorias
Lanche da tarde – 200 calorias
Jantar – 600 calorias
Total: 2.000 calorias
Vídeos sobre os valores calóricos dos alimentos
http://www.youtube.com/watch?v=9sf_GIAgSNE
http://www.youtube.com/watch?v=uopJeFYdSdM
quarta-feira, 21 de novembro de 2012
Fotos das aulas práticas sobre os fatores que influenciam na velocidade da reação.
2º A Tarde
2º C Manhã

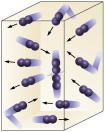
Moléculas se colidem com maior frequência se
aumentarmos o número de moléculas reagentes.

Um aumento na pressão de P1 para P 2 reduziu o volume de V1 para V1/2, acelerando a reação devido à aproximação das moléculas.
2º C Manhã
Cinética Química

Quando o combustível é oxidado na
câmara de combustão, libera-se calor, aumentando a energia cinética de
suas moléculas.
Existe um ramo na ciência que estuda
a velocidade das reações químicas e os fatores que a influenciam, é a
chamada Cinética Química. Pode se definir reações químicas como sendo um
conjunto de fenômenos nos quais duas ou mais substâncias reagem entre
si, dando origem a diferentes compostos. Equação química é a
representação gráfica de uma reação química, onde os reagentes aparecem
no primeiro membro, e os produtos no segundo.
A + B  C + D
C + D
Reagentes Produtos
Reagentes Produtos
O conhecimento e o estudo das reações, além de ser muito importante em
termos industriais, também estão relacionados ao nosso dia a dia.
A velocidade de uma reação é a rapidez com que os reagentes são consumidos ou rapidez com que os produtos são formados. A combustão de uma vela e a formação de ferrugem são exemplos de reações lentas. Na dinamite, a decomposição da nitroglicerina é uma reação rápida.
As velocidades das reações químicas são determinadas através de leis empíricas, chamadas leis da velocidade, deduzidas a partir do efeito da concentração dos reagentes e produtos na velocidade da reação.
As reações químicas ocorrem com velocidades diferentes e estas podem ser alteradas, porque além da concentração de reagentes e produtos, as velocidades das reações dependem também de outros fatores como:
Concentração de reagentes: quanto maior a concentração dos reagentes maior será a velocidade da reação. Para que aconteça uma reação entre duas ou mais substâncias é necessário que as moléculas se choquem, de modo que haja quebra das ligações com consequente formação de outras novas. O número de colisões irá depender das concentrações de A e B. Veja a figura:
A velocidade de uma reação é a rapidez com que os reagentes são consumidos ou rapidez com que os produtos são formados. A combustão de uma vela e a formação de ferrugem são exemplos de reações lentas. Na dinamite, a decomposição da nitroglicerina é uma reação rápida.
As velocidades das reações químicas são determinadas através de leis empíricas, chamadas leis da velocidade, deduzidas a partir do efeito da concentração dos reagentes e produtos na velocidade da reação.
As reações químicas ocorrem com velocidades diferentes e estas podem ser alteradas, porque além da concentração de reagentes e produtos, as velocidades das reações dependem também de outros fatores como:
Concentração de reagentes: quanto maior a concentração dos reagentes maior será a velocidade da reação. Para que aconteça uma reação entre duas ou mais substâncias é necessário que as moléculas se choquem, de modo que haja quebra das ligações com consequente formação de outras novas. O número de colisões irá depender das concentrações de A e B. Veja a figura:

Moléculas se colidem com maior frequência se
aumentarmos o número de moléculas reagentes.
É fácil perceber que devido a uma maior concentração haverá aumento das colisões entre as moléculas.
Superfície de contato: um aumento da superfície de contato aumenta a velocidade da reação. Um exemplo é quando dissolvemos um comprimido de sonrisal triturado e ele se dissolve mais rapidamente do que se estivesse inteiro, isto acontece porque aumentamos a superfície de contato que reage com a água.
Pressão: quando se aumenta a pressão de um sistema gasoso, aumenta-se a velocidade da reação.
Superfície de contato: um aumento da superfície de contato aumenta a velocidade da reação. Um exemplo é quando dissolvemos um comprimido de sonrisal triturado e ele se dissolve mais rapidamente do que se estivesse inteiro, isto acontece porque aumentamos a superfície de contato que reage com a água.
Pressão: quando se aumenta a pressão de um sistema gasoso, aumenta-se a velocidade da reação.

Um aumento na pressão de P1 para P 2 reduziu o volume de V1 para V1/2, acelerando a reação devido à aproximação das moléculas.
A figura acima exemplifica, pois com a diminuição do volume no segundo
recipiente, haverá um aumento da pressão intensificando as colisões das
moléculas e em consequência ocorrerá um aumento na velocidade da reação.
Temperatura: quando se aumenta a temperatura de um sistema, ocorre também um aumento na velocidade da reação. Aumentar a temperatura significa aumentar a energia cinética das moléculas. No nosso dia a dia podemos observar esse fator quando estamos cozinhando e aumentamos a chama do fogão para que o alimento atinja o grau de cozimento mais rápido.
Catalisadores: os catalisadores são substâncias que aceleram o mecanismo sem sofrerem alteração permanente, isto é, durante a reação eles não são consumidos. Os catalisadores permitem que a reação tome um caminho alternativo, que exige menor energia de ativação, fazendo com que a reação se processe mais rapidamente. É importante lembrar que um catalisador acelera a reação, mas não aumenta o rendimento, ou seja, ele produz a mesma quantidade de produto, mas num período de menor tempo.
Temperatura: quando se aumenta a temperatura de um sistema, ocorre também um aumento na velocidade da reação. Aumentar a temperatura significa aumentar a energia cinética das moléculas. No nosso dia a dia podemos observar esse fator quando estamos cozinhando e aumentamos a chama do fogão para que o alimento atinja o grau de cozimento mais rápido.
Catalisadores: os catalisadores são substâncias que aceleram o mecanismo sem sofrerem alteração permanente, isto é, durante a reação eles não são consumidos. Os catalisadores permitem que a reação tome um caminho alternativo, que exige menor energia de ativação, fazendo com que a reação se processe mais rapidamente. É importante lembrar que um catalisador acelera a reação, mas não aumenta o rendimento, ou seja, ele produz a mesma quantidade de produto, mas num período de menor tempo.
sexta-feira, 9 de novembro de 2012
quinta-feira, 8 de novembro de 2012
Cinética Química: o efeito da Temperatura, Concentração e Catalisador
Condições para a ocorrência de reações

Ao observarmos os fenômenos do cotidiano, notamos que existem alguns fatores para a ocorrência das reações químicas
Imagine três situações diferentes:
(1ª) Ao colocarmos sódio metálico na água, a reação ocorre violentamente, de forma rápida;
(2ª) Ao abrirmos a válvula de um fogareiro, o gás irá escapar, porém a
reação só ocorrerá se colocarmos um palito de fósforo aceso no
queimador;
(3ª) Ao deixar um giz em contato com o ar, não acontecerá nada, nem mesmo se aproximarmos dele um palito de fósforo aceso.
O que essas três situações nos mostram? Que algumas
reações ocorrem espontaneamente, como no primeiro caso. Já para que
outras ocorram é necessário o fornecimento de energia, como no segundo
exemplo. E, por fim, na terceira situação, vimos que nem todos os
fenômenos resultam em reação química.
Assim, existem algumas condições necessárias para a ocorrência das reações, entre elas as principais são: natureza dos reagentes, contato entre eles e energia de ativação.
- Natureza dos Reagentes ou “Afinidade Química” → No dia a dia observa-se que algumas substâncias possuem diferentes afinidades químicas umas com as outras, ou seja, a natureza dos reagentes define se há a possibilidade de reagirem entre si.
Como no caso do giz não existe afinidade química entre seus componentes
e o ar, eles não reagem. Já o sódio é muito reativo tanto com a água
como com o ar, assim ele precisa ser guardado em querosene, para não
reagir com o oxigênio presente no ar.
- Contato entre os Reagentes → Ácidos e bases reagem, pois eles possuem a afinidade citada no item anterior. Porém, se estiverem em frascos separados, não irão reagir. É fundamental que as espécies reagentes sejam colocadas em contato para que as partículas que formam seus aglomerados possam colidir umas com as outras, rompendo as ligações que existem e formando novas ligações (e, consequentemente, novas substâncias).
- Energia de Ativação e Teoria da Colisão → Toda reação só ocorre se no sistema tiver uma energia mínima necessária, que varia de reagente para reagente. Essa energia é denominada energia de ativação.
No primeiro exemplo, a reação ocorre espontaneamente porque o próprio
sistema já contém a energia de ativação necessária. No segundo caso, é
necessário fornecer energia aos reagentes para que eles atinjam a
energia de ativação. Isso é feito por meio da chama do palito de
fósforo.
A Teoria das Colisões explica por que algumas
substâncias têm afinidade química e outras não; e também como se obtém a
energia de ativação para dar início à reação. Essa teoria explica que
quando as moléculas dos reagentes colidem, para que seja uma colisão
efetiva que rompa suas ligações e forme novas, tem que se dar com duas
condições muito importantes: a energia envolvida na colisão tem que ser maior que a energia de ativação e deve ser uma colisão com orientação adequada. Se isso não ocorrer, a reação também não ocorrerá.
Por Jennifer Rocha Vargas Fogaça
ARTIGOS RELACIONADOS
- A lei da velocidade das reações é a relação existente entre as concentrações dos reagentes e a velocidade...
-

Cinética Química
A cinética química constitui um ramo da Química que estuda a velocidade das reações.
-

Velocidade Média das Reações Químicas
A variação da quantidade de reagente ou produto em função de uma variação de tempo corresponde à...
-

Química dos airbags
Conheça as reações químicas presentes no airbag e o mecanismo de funcionamento desse dispositivo que salva...
-

Influências na velocidade das reações
Para influenciar a velocidade das reações é possível utilizar alguns fatores que as aceleram ou as retardam.
Experimento com Balões
Cinética química
Estudando cinética química por meio de aulas experimentais
Em nosso dia a dia, nos deparamos com processos que precisam ser acelerados
para que possamos obter resultados mais rápidos, como por exemplo, quando optamos
por cozinhar alimentos na panela de pressão. Outras vezes, precisamos desacelerar uma
reação para retardar um processo químico. Um exemplo disso é quando colocamos
alimentos na geladeira para que se torne mais lenta sua deterioração.
A chamada Cinética Química estuda a velocidade que as reações químicas
acontecem e os fatores que a influenciam. Podemos definir reações químicas como
sendo um conjunto de fenômenos nos quais duas ou mais substâncias reagem entre si,
dando origem a diferentes compostos. As reações químicas ocorrerem com velocidades
diferentes e podem ser alteradas por alguns fatores, como: temperatura, concentração
dos reagentes, superfície de contato, presença de catalisador e pressão.
Em nosso dia a dia, nos deparamos com processos que precisam ser acelerados
para que possamos obter resultados mais rápidos, como por exemplo, quando optamos
por cozinhar alimentos na panela de pressão. Outras vezes, precisamos desacelerar uma
reação para retardar um processo químico. Um exemplo disso é quando colocamos
alimentos na geladeira para que se torne mais lenta sua deterioração.
A chamada Cinética Química estuda a velocidade que as reações químicas
acontecem e os fatores que a influenciam. Podemos definir reações químicas como
sendo um conjunto de fenômenos nos quais duas ou mais substâncias reagem entre si,
dando origem a diferentes compostos. As reações químicas ocorrerem com velocidades
diferentes e podem ser alteradas por alguns fatores, como: temperatura, concentração
dos reagentes, superfície de contato, presença de catalisador e pressão.
- INFLUÊNCIAS NA VELOCIDADE DAS REAÇÕES QUÍMICAS
Os principais fatores que alteram a velocidade das reações são: superfície de contato, temperatura, catalisadores, concentração Ode reagentes.SUPERFÍCIE DE CONTATOPara investigar o efeito da superfície de contato na velocidade, vamos considerar a reação a seguir:CaCO3(s) + H2SO4(aq) ®- CaSO4(S) + H2O(l) + CO2(g)e medir o tempo necessário para obter o mesmo volume de CO2(g) usando massas iguais de CaCO3 sólido e volumes iguais de uma mesma solução aquosa de H2SO4 , com o auxílio da seguinte aparelhagem: O tempo necessário para produzir 20 cm3 de CO2 em cada experimento é:Experimento I: 50 segundos;Experimento II: 20 segundos;Experimento III: 8 segundos.Nesses experimentos, o único fator que sofreu variação foi a superfície de contato do CaCO3 sólido. O tempo necessário para produzir o mesmo volume de CO2(g) quando utilizamos a placa de CaCO3(s) (experimento 1) foi maior (50 s), pois essa placa apresenta a menor superfície de contato; quando usamos CaCO3(s) em pó, o tempo necessário foi menor (8 s), pois o pó apresenta a maior superfície de contato.Isso ocorre porque as colisões entre as moléculas acontecem na superfície do sólido e, considerando que quanto mais fragmentado está o sólido, maior é a superfície exposta, o número de colisões aumenta, determinando também um aumento na velocidade da reação.Observando a representação gráfica dos três experimentos, notamos que, com o aumento da superfície, aumentou a velocidade da reação e não a quantidade de produto formado.
O tempo necessário para produzir 20 cm3 de CO2 em cada experimento é:Experimento I: 50 segundos;Experimento II: 20 segundos;Experimento III: 8 segundos.Nesses experimentos, o único fator que sofreu variação foi a superfície de contato do CaCO3 sólido. O tempo necessário para produzir o mesmo volume de CO2(g) quando utilizamos a placa de CaCO3(s) (experimento 1) foi maior (50 s), pois essa placa apresenta a menor superfície de contato; quando usamos CaCO3(s) em pó, o tempo necessário foi menor (8 s), pois o pó apresenta a maior superfície de contato.Isso ocorre porque as colisões entre as moléculas acontecem na superfície do sólido e, considerando que quanto mais fragmentado está o sólido, maior é a superfície exposta, o número de colisões aumenta, determinando também um aumento na velocidade da reação.Observando a representação gráfica dos três experimentos, notamos que, com o aumento da superfície, aumentou a velocidade da reação e não a quantidade de produto formado. TEMPERATURAMuitos acontecimentos cotidianos podem servir para demonstrar a relação entre a mudança na velocidade das reações e a mudança de temperatura.Um alimento cozinha mais rapidamente numa panela de pressão, por exemplo, porque nesse tipo de panela a água ferve a uma temperatura maior, o que favorece o cozimento. Para a melhor conservação de alimentos, eles são guardados em refrigeradores ou freezers, que apresentam temperaturas menores que a do ambiente, diminuindo a velocidade das reações responsáveis pela decomposição.Outro exemplo da influência da temperatura na velocidade das reações ocorre com a combustão, que é uma reação exotérmica. Em um ambiente onde a perda de calor é pequena (como em uma floresta), a temperatura do ambiente aumenta e provoca um aumento na velocidade de reação de combustão. É isso o que torna os incêndios, especialmente os florestais, tão devastadores.O primeiro cientista a relacionar a variação de temperatura e a velocidade das reações foi Jacobus Van't Hoff, no final do século XIX. Ele percebeu que, em algumas reações, uma elevação de 10°C durante a reação fazia com que a velocidade dobrasse. A partir desse fato, ele estabeleceu a seguinte regra, conhecida por regra de Van't Hoff.Um aumento na temperatura provoca um aumento na energia cinética média das moléculas e, com isso, um aumento no número de colisões, o que irá acarretar aumento da velocidade da reação. Em um sistema, nem todas as moléculas apresentam a mesma energia cinética e somente uma fração delas (representada na área destacada do gráfico) possui energia suficiente para reagir:
TEMPERATURAMuitos acontecimentos cotidianos podem servir para demonstrar a relação entre a mudança na velocidade das reações e a mudança de temperatura.Um alimento cozinha mais rapidamente numa panela de pressão, por exemplo, porque nesse tipo de panela a água ferve a uma temperatura maior, o que favorece o cozimento. Para a melhor conservação de alimentos, eles são guardados em refrigeradores ou freezers, que apresentam temperaturas menores que a do ambiente, diminuindo a velocidade das reações responsáveis pela decomposição.Outro exemplo da influência da temperatura na velocidade das reações ocorre com a combustão, que é uma reação exotérmica. Em um ambiente onde a perda de calor é pequena (como em uma floresta), a temperatura do ambiente aumenta e provoca um aumento na velocidade de reação de combustão. É isso o que torna os incêndios, especialmente os florestais, tão devastadores.O primeiro cientista a relacionar a variação de temperatura e a velocidade das reações foi Jacobus Van't Hoff, no final do século XIX. Ele percebeu que, em algumas reações, uma elevação de 10°C durante a reação fazia com que a velocidade dobrasse. A partir desse fato, ele estabeleceu a seguinte regra, conhecida por regra de Van't Hoff.Um aumento na temperatura provoca um aumento na energia cinética média das moléculas e, com isso, um aumento no número de colisões, o que irá acarretar aumento da velocidade da reação. Em um sistema, nem todas as moléculas apresentam a mesma energia cinética e somente uma fração delas (representada na área destacada do gráfico) possui energia suficiente para reagir: Como, com a elevação da temperatura, ocorre um aumento na energia cinética média das moléculas, há alteração na distribuição dessa energia. Dessa maneira, aumenta a quantidade de moléculas com energia suficiente para reagir e, conseqüentemente, há aumento na velocidade da reação.
Como, com a elevação da temperatura, ocorre um aumento na energia cinética média das moléculas, há alteração na distribuição dessa energia. Dessa maneira, aumenta a quantidade de moléculas com energia suficiente para reagir e, conseqüentemente, há aumento na velocidade da reação. CATALISADORNosso sistema digestivo converte os nutrientes (proteínas, carboidratos e gorduras) em substâncias que podem ser absorvidas e usadas pelas células. Essas transformações ocorreriam demasiadamente devagar se não existissem, em nosso organismo, substâncias capazes de acelerar o metabolismo, ou seja, as reações do organismo, sem serem consumidas nessas reações. Essas substâncias são um tipo de proteínas denominadas enzimas e constituem os catalisadores biológicos, ou biocatalisadores, e são altamente específicas.Catalisadores: Substâncias capazes de acelerar uma reação sem sofrerem alteração, isto é, não são consumidas durante a reação.Os catalisadores têm a capacidade de diminuir a energia de ativação, fazendo com que a reação se processe de maneira diferente.
CATALISADORNosso sistema digestivo converte os nutrientes (proteínas, carboidratos e gorduras) em substâncias que podem ser absorvidas e usadas pelas células. Essas transformações ocorreriam demasiadamente devagar se não existissem, em nosso organismo, substâncias capazes de acelerar o metabolismo, ou seja, as reações do organismo, sem serem consumidas nessas reações. Essas substâncias são um tipo de proteínas denominadas enzimas e constituem os catalisadores biológicos, ou biocatalisadores, e são altamente específicas.Catalisadores: Substâncias capazes de acelerar uma reação sem sofrerem alteração, isto é, não são consumidas durante a reação.Os catalisadores têm a capacidade de diminuir a energia de ativação, fazendo com que a reação se processe de maneira diferente. O primeiro cientista a explicar a ação de um catalisador foi Arrhenius, em 1889. Ele afirmava que o catalisador se combina com o reagente, originando um composto intermediário que, por sua vez, se transforma, originando o produto e se regenerando em seguida. Considerando a reação genérica a seguir, de acordo com esse raciocínio temos:
O primeiro cientista a explicar a ação de um catalisador foi Arrhenius, em 1889. Ele afirmava que o catalisador se combina com o reagente, originando um composto intermediário que, por sua vez, se transforma, originando o produto e se regenerando em seguida. Considerando a reação genérica a seguir, de acordo com esse raciocínio temos: Note que a soma dos dois passos corresponde à reação genérica que pode ser representada pela equação e pelo gráfico a seguir:A + B ¾C® AB
Note que a soma dos dois passos corresponde à reação genérica que pode ser representada pela equação e pelo gráfico a seguir:A + B ¾C® AB

OBSERVAÇÕES1. Um catalisador acelera a reação, mas não aumenta o seu rendimento, isto é, ele produz a mesma quantidade de produto, mas num período de tempo menor. 2.O catalisador não altera o DH da reação.3.Um catalisador acelera tanto a reação direta quanto a inversa, pois diminui a energia de ativação de ambas.
2.O catalisador não altera o DH da reação.3.Um catalisador acelera tanto a reação direta quanto a inversa, pois diminui a energia de ativação de ambas.
As reações que ocorrem na presença de catalisadores são denominadas catálises, que podem ser de dois tipos: homogênea e heterogênea.Catálise homogêneaNesse tipo de reação, os reagentes e o catalisador formam um sistema monofásico ou homogêneo. Veja os exemplos: Catálise heterogêneaNesse tipo de reação, os reagentes e o catalisador formam um sistema com mais de uma fase. Veja os exemplos:
Catálise heterogêneaNesse tipo de reação, os reagentes e o catalisador formam um sistema com mais de uma fase. Veja os exemplos: AutocatáliseÉ um tipo de reação na qual um dos produtos formados atua como catalisador. Um exemplo é a reação que ocorre entre o cobre (Cu) e o ácido nítrico (HNO3 ):
AutocatáliseÉ um tipo de reação na qual um dos produtos formados atua como catalisador. Um exemplo é a reação que ocorre entre o cobre (Cu) e o ácido nítrico (HNO3 ): Inicialmente, a reação ocorre lentamente; porém, à medida que o óxido de nitrogênio (NO) é formado, ele age como catalisador, aumentando violentamente a velocidade da reação.Veneno ou inibidor de catalisadorE uma substância que se combina com o catalisador, diminuindo ou anulando a sua ação. O método industrial de produção de amônia (NH3), conhecido por Haber-Bosch, só é vantajoso pela ação catalitica do ferro (Fe):N2(g) + 3 H2(g) ¾ Fe® 2NH3(g)No entanto, sua eficiência se torna muito pequena se ocorrer a presença de arsênico (As), que inibe a ação do ferro, ou seja, é o veneno de catalisador.CONCENTRAÇÃO DE REAGENTESEm um pedaço de carvão em brasa, as moléculas de oxigênio 02(g) presentes no ar estão colidindo com o carvão. No entanto, apenas 20% das moléculas do ar são de 02(g); as demais também estão colidindo com o carvão, mas não participam da reação. Nessa situação, o carvão queima lentamente.
Inicialmente, a reação ocorre lentamente; porém, à medida que o óxido de nitrogênio (NO) é formado, ele age como catalisador, aumentando violentamente a velocidade da reação.Veneno ou inibidor de catalisadorE uma substância que se combina com o catalisador, diminuindo ou anulando a sua ação. O método industrial de produção de amônia (NH3), conhecido por Haber-Bosch, só é vantajoso pela ação catalitica do ferro (Fe):N2(g) + 3 H2(g) ¾ Fe® 2NH3(g)No entanto, sua eficiência se torna muito pequena se ocorrer a presença de arsênico (As), que inibe a ação do ferro, ou seja, é o veneno de catalisador.CONCENTRAÇÃO DE REAGENTESEm um pedaço de carvão em brasa, as moléculas de oxigênio 02(g) presentes no ar estão colidindo com o carvão. No entanto, apenas 20% das moléculas do ar são de 02(g); as demais também estão colidindo com o carvão, mas não participam da reação. Nessa situação, o carvão queima lentamente. Se colocamos esse carvão em brasa em um frasco contendo gás oxigênio puro, ele se inflama. Isso se deve ao fato de que, nesse caso, todas as moléculas que se chocam com o carvão são de 02(g), o que permite concluir que o aumento da concentração de oxigênio passou de 20% para 100% e provocou um aumento na velocidade da reação.A partir desse fato, podemos concluir que a velocidade de uma reação depende também da concentração dos reagentes, pois ela está relacionada com o número de choques entre as moléculas. Vamos aplicar esse conceito a uma reação genérica:1A + 1B ® 1ABO número de choques e, conseqüentemente, a velocidade irão depender das concentrações de A e B. Vamos considerar quatro situações em que varia o número de moléculas de A e B, num mesmo volume e numa mesma temperatura:
Se colocamos esse carvão em brasa em um frasco contendo gás oxigênio puro, ele se inflama. Isso se deve ao fato de que, nesse caso, todas as moléculas que se chocam com o carvão são de 02(g), o que permite concluir que o aumento da concentração de oxigênio passou de 20% para 100% e provocou um aumento na velocidade da reação.A partir desse fato, podemos concluir que a velocidade de uma reação depende também da concentração dos reagentes, pois ela está relacionada com o número de choques entre as moléculas. Vamos aplicar esse conceito a uma reação genérica:1A + 1B ® 1ABO número de choques e, conseqüentemente, a velocidade irão depender das concentrações de A e B. Vamos considerar quatro situações em que varia o número de moléculas de A e B, num mesmo volume e numa mesma temperatura: Isso demonstra que o número de colisões e, conseqüentemente, a velocidade da reação são proporcionais ao produto das concentrações.Observação: Em reações envolvendo reagentes gasosos, quando se aumenta a pressão, ocorre uma diminuição de volume e conseqüentemente há aumento nas concentrações dos reagentes.
Isso demonstra que o número de colisões e, conseqüentemente, a velocidade da reação são proporcionais ao produto das concentrações.Observação: Em reações envolvendo reagentes gasosos, quando se aumenta a pressão, ocorre uma diminuição de volume e conseqüentemente há aumento nas concentrações dos reagentes.
Assinar:
Postagens (Atom)


















